Tinjauan vaksin terhadap respiratory syncytial virus
Respiratory syncytial virus (RSV) menyebabkan penyakit pernapasan seperti pneumonia dan bronkiolitis, terutama menyerang anak-anak balita dan orang tua di atas 65 tahun.
Temuan tinjauan terbaru yang diterbitkan di Vacunas meninjau
epidemiologi, karakteristik molekuler, populasi yang terkena virus, dan vaksin
terhadap RSV.
Latar belakang
Setiap tahun RSV menginfeksi jutaan anak balita dan orang
tua di atas 65 tahun, menyebabkan jutaan rawat inap dan ribuan kematian.
Penyakit ini berbentuk epidemi selama musim dingin. Hampir setiap anak
mengalami setidaknya satu episode infeksi RSV pada usia tiga tahun; infeksi
ulang terjadi baik setiap tahun atau setelah setiap tiga sampai lima tahun.
Ini menggambarkan ketidakmampuan sistem kekebalan untuk
memberikan perlindungan jangka panjang terhadap virus. Oleh karena itu,
vaksinasi RSV sangat penting untuk wanita hamil, anak-anak di bawah usia dua
tahun (sebaiknya segera setelah mencapai enam bulan), dan populasi senior.
Karakteristik molekuler RSV
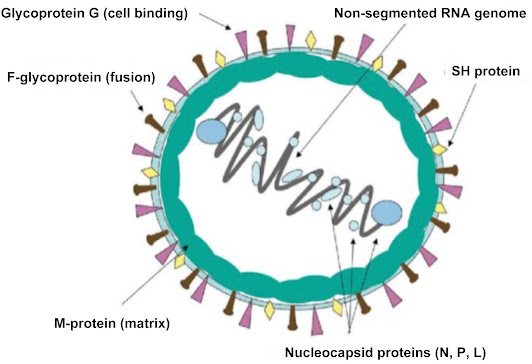
RSV adalah virus RNA berselubung milik keluarga
Pneumoviridae dengan sepuluh gen yang mengkode 11 protein. Protein yang
ditemukan dalam amplop virus adalah small hydrophobic protein (SH), matrix
protein (M), glycoprotein F (fusion), and attachment glycoprotein (G). Glikoprotein
G dan F memberikan infektivitas terhadap virus; yang pertama menempelkan virus
ke sel inang, dan yang terakhir memfasilitasi masuknya virus ke dalam sel dan
menghasilkan pembentukan syncytia yang patognomik terhadap penyakit ini.
Glikoprotein G dan F adalah tipe imunodominan, menginduksi
antibodi penetralisir di dalam inang. Glikoprotein G memiliki tiga jenis epitop
– conserved (present in all strains), group-specific, dan species-specific.
Prekursor glikoprotein F tidak aktif dan mengandung tiga peptida hidrofobik –
peptida sinyal, daerah transmembran, dan peptida fusi.
RSV memiliki dua subkelompok, A dan B, yang bersirkulasi
secara bergantian atau bersama-sama, berbeda secara antigen oleh urutan
glikoprotein G. Oleh karena itu, antibodi terhadap glikoprotein G mungkin
spesifik subtipe, sedangkan antibodi terhadap glikoprotein F sebagian besar
memiliki aktivitas penetralan terhadap kedua subkelompok.
Umumnya, glikoprotein F digunakan sebagai antigen untuk
mengembangkan vaksin. Glikoprotein ini memiliki dua presentasi (pre-fusion or
pre-F dan post-fusion or post-F). Di antaranya, situs antigenik di pre-F (“site
zero”) adalah penginduksi antibodi penetral yang paling kuat.
Vaksinasi RSV
RSV menghindari kekebalan inang dengan berbagai mekanisme,
tiga di antaranya telah dikenali - penghindaran konformasi dan anatomi antibodi
penetralisir dan modulasi kekebalan langsung. Semua ini harus diperhitungkan
selama pengembangan vaksin.
Infeksi yang disebabkan oleh RSV bersifat self-limiting –
manusia adalah satu-satunya reservoir alami. Populasi target vaksinasi adalah
anak-anak di bawah enam bulan dan lebih tua dan orang tua di atas 65 tahun.
Sistem kekebalan bayi yang sedang berkembang belum matang
dan tidak mampu memberikan perlindungan dari antigen eksogen. Oleh karena itu,
kelompok usia ini merupakan populasi prioritas untuk vaksinasi RSV; penggunaan
antibodi monoklonal dianggap sebagai pilihan yang tepat.
Vaksinasi ibu selama kehamilan adalah pilihan imunisasi
terbaik. Selain transfer antibodi transplasental, imunoglobulin A yang
ditransfer selama menyusui memberikan perlindungan kepada bayi. RSV biasanya
menyerang anak-anak antara usia enam bulan hingga dua tahun. Dengan demikian,
bayi dan anak-anak antara enam bulan dan lima tahun merupakan kelompok sasaran
lain; vaksinasi bertujuan untuk membatasi sirkulasi virus dan efek
kolateralnya.
Kelompok sasaran ketiga adalah penduduk lanjut usia (65
tahun ke atas). Hampir 3-10% dari semua infeksi saluran pernapasan akut pada
kelompok usia ini disebabkan oleh RSV, yang berjumlah hampir 250.000 rawat inap
dan 14.000 kematian setiap tahunnya. Selain itu, menurunnya kekebalan dan
penyakit lain yang mendasarinya membuat populasi ini rentan terhadap infeksi
pernapasan.
Sebagai catatan, vaksin mRNA lebih menguntungkan daripada
yang lain karena profil keamanannya yang tinggi, produksi antigen yang sangat
terkontrol dengan identitas antigenik yang tinggi, proses produksi yang dapat
diskalakan dan cepat, dan produksi tanpa kultur sel.
Vaksin mRNA non-replikatif, konvensional, seperti seluler
yang menargetkan RSV telah dikembangkan. Ini terdiri dari dua jenis - mRNA yang
tidak dimodifikasi dan m RNA yang dimodifikasi. Vaksin ini menginduksi respon
imun yang sangat spesifik karena mereka mengkodekan protein tunggal. Namun,
dosis tinggi diperlukan untuk menginduksi kemanjuran yang cukup. Selanjutnya,
untuk melindungi dari degradasi dan kerapuhan yang cepat, molekul mRNA
dienkapsulasi dalam struktur lipid kompleks – yang dikenal sebagai nanopartikel
lipid.
Pre-fusion (pre-F) memiliki spesifisitas antigenik yang
lebih baik dan potensi afinitas yang lebih tinggi karena sebagian besar
antibodi penetral menargetkan "situs nol". Oleh karena itu, antigen
yang melindungi dan memelihara epitop ini lebih disukai.
Sementara itu, vaksin ini menimbulkan risiko minimal untuk
efek samping, kecuali reaksi lokal di tempat suntikan. Bahkan dosis tertinggi
(300 g) menunjukkan risiko rendah untuk efek samping. Uji coba fase 1
mengkonfirmasi imunogenisitas dan keamanan vaksin NPL-m RNA, sementara hasil
uji coba fase 2 ditunggu.
Ringkasan
Penelitian ini mengkaji epidemiologi, karakteristik
molekuler, populasi yang terkena virus, dan vaksin RSV. Hanya memiliki satu
reservoir membuatnya ideal untuk mengembangkan vaksin melawan RSV. Kebanyakan
vaksin menggunakan glikoprotein F (bentuk pra-fusi) sebagai antigen. Baru-baru
ini, vaksin mRNA telah dikembangkan dengan antigenisitas dan kemanjuran yang
menjanjikan. Lebih banyak penelitian diperlukan untuk mempelajari kemanjuran
vaksin m RNA terhadap virus lain yang mempengaruhi populasi manusia.
Journal reference:
Reina, J. and Fernández-Billón, M. (2022) "Preliminary
data on messenger RNA (mRNA) vaccines against respiratory syncytial
virus", Vacunas (English Edition). doi: 10.1016/j.vacune.2022.10.007.
https://www.sciencedirect.com/science/article/abs/pii/S2445146022000760





No comments